CALB immobilisé
Le CALB est immobilisé par adsorption physique sur la résine hautement hydrophobe qui est un polymère styrène/méthacrylate macroporeux.Le CALB immobilisé convient aux applications dans les solvants organiques et les systèmes sans solvant, et peut être recyclé et réutilisé plusieurs fois dans des conditions appropriées.
Code produit : SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★ Activité plus élevée, sélectivité chirale plus élevée et stabilité plus élevée.
★Meilleures performances dans les phases non aqueuses.
★Retirez facilement du système de réaction, terminez rapidement les réactions et évitez les résidus de protéines dans le produit.
★Peut être recyclé et réutilisé pour réduire les coûts.
| Activité | ≥10000PLU/g |
| Plage de pH pour la réaction | 5-9 |
| Plage de température pour la réaction | 10-60℃ |
| Apparence | CALB-IMMO100-A : Solide jaune clair à brun CALB-IMMO100-B : Solide blanc à marron clair |
| La taille des particules | 300-500μm |
| Perte au séchage à 105℃ | 0.5%-3.0% |
| Résine pour immobilisation | Macroporeux, polymère styrène/méthacrylate |
| Solvant de réaction | Eau, solvant organique, etc., ou sans solvant.Pour la réaction dans certains solvants organiques, 3% d'eau peut être ajouté pour améliorer l'effet de réaction |
| La taille des particules | CALB-IMMO100-A : 200-800 μm CALB-IMMO100-B : 400-1200 μm |
Définition de l'unité : 1 unité correspond à la synthèse de 1μmol par minute de laurate de propyle à partir d'acide laurique et de 1-propanol à 60℃.Les CALB-IMMP100-A et CALB-IMMO100-B ci-dessus correspondent à des supports immobilisés avec différentes tailles de particules.
1. Type de réacteur
L'enzyme immobilisée est applicable à la fois au réacteur discontinu à bouilloire et au réacteur à flux continu à lit fixe.Il convient de noter qu'il faut éviter l'écrasement dû à une force externe lors de l'alimentation ou du remplissage.
2. pH de réaction, température et solvant
L'enzyme immobilisée doit être ajoutée en dernier, après d'autres matériaux ajoutés et dissous, et le pH ajusté.
Si la consommation de substrat ou la formation de produit entraîne un changement de pH au cours de la réaction, une quantité suffisante de tampon doit être ajoutée au système de réaction, ou le pH doit être surveillé et ajusté au cours de la réaction.
Dans la plage de tolérance de température de CALB (inférieure à 60 ℃), le taux de conversion a augmenté avec l'augmentation de la température.En pratique, la température de réaction doit être choisie en fonction de la stabilité du substrat ou du produit.
Généralement, la réaction d'hydrolyse d'ester convient dans un système en phase aqueuse, tandis que la réaction de synthèse d'ester convient dans un système en phase organique.Le solvant organique peut être l'éthanol, le tétrahydrofurane, le n-hexane, le n-heptane et le toluène, ou un solvant mixte approprié.Pour la réaction dans certains solvants organiques, 3 % d'eau peuvent être ajoutés pour améliorer l'effet de réaction.
3. Réutilisation et durée de vie de CALB
Dans les conditions de réaction appropriées, CALB peut être récupéré et réutilisé, et les temps d'application spécifiques varient selon les projets.
Si le CALB récupéré n'est pas réutilisé en continu et doit être stocké après récupération, il doit être lavé et séché et scellé à 2-8 ℃.
Après plusieurs cycles de réutilisation, si l'efficacité de la réaction est légèrement réduite, CALB peut être ajouté de manière appropriée et continuer à être utilisé.Si l'efficacité de la réaction est sérieusement réduite, il doit être remplacé.
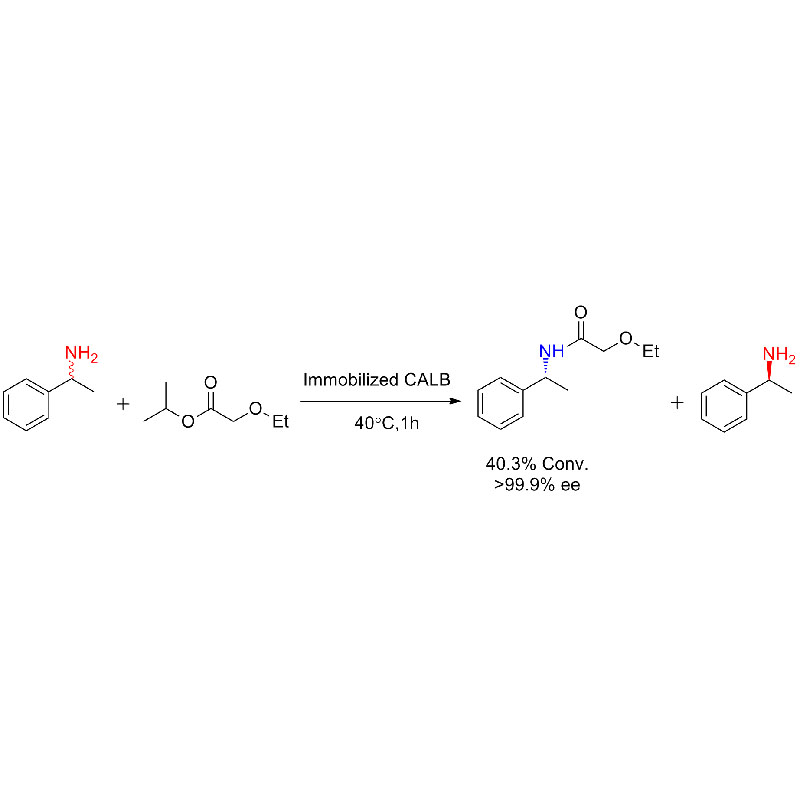
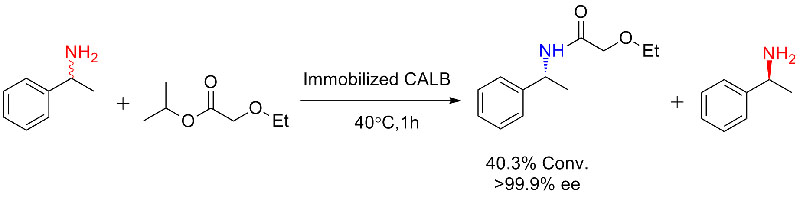
Exemple 1 (Aminolyse)(1):
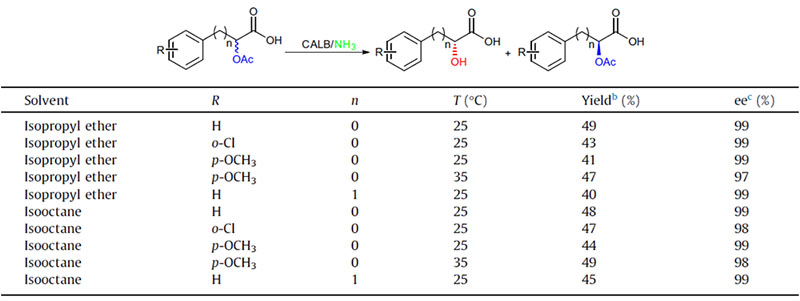
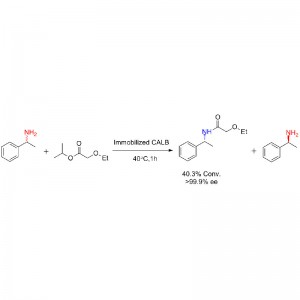
Exemple 2 (Aminolyse)(2):
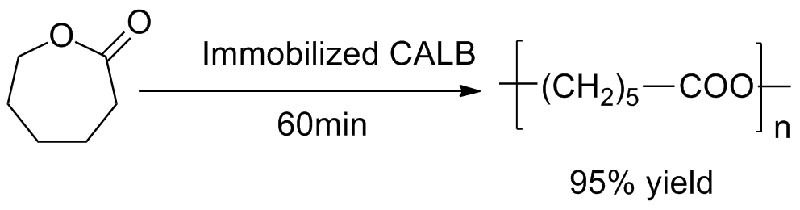
Exemple 3 (synthèse de polyester à ouverture de cycle)(3):
Exemple 4 (transestérification, régiosélective du groupe hydroxyle)(4):
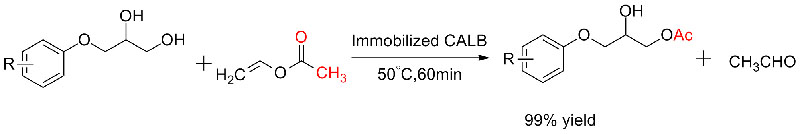
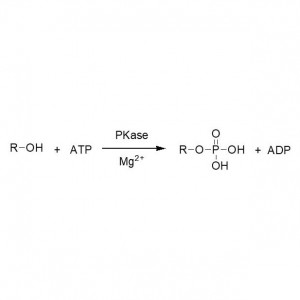
Exemple 5(Transestérification, résolution cinétique des alcools racémiques)(5):
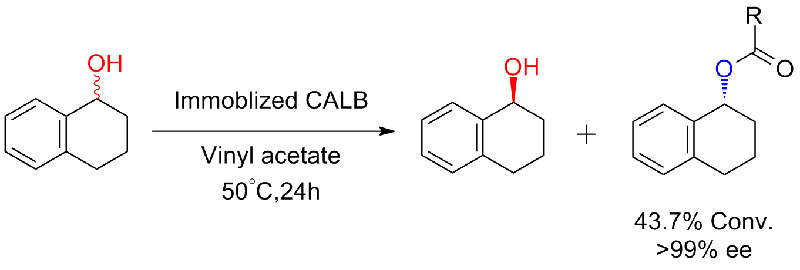
Exemple 6 (Estérification, résolution cinétique d'acide carboxylique)(6):
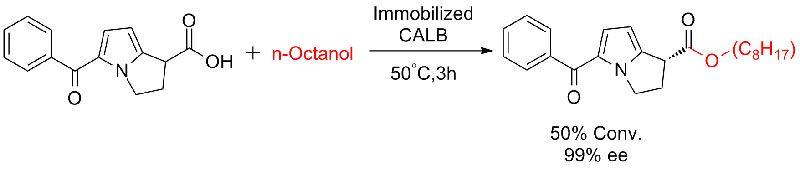
Exemple 7 (Estérolyse, résolution cinétique)(sept):
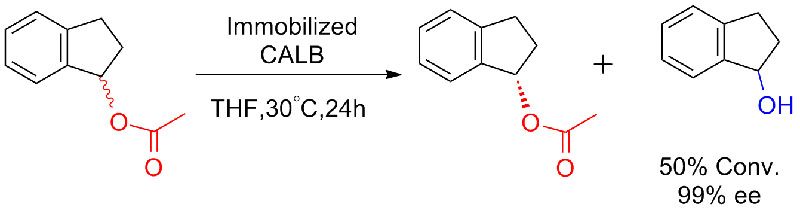
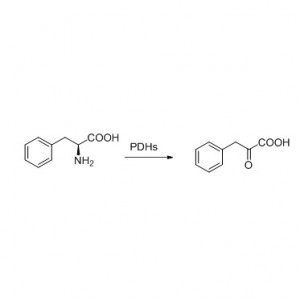
Exemple 8 (hydrolyse d'amides)(8):
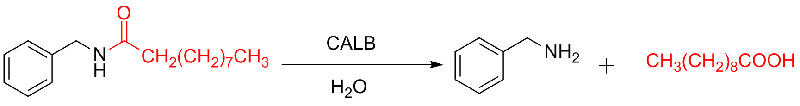
Exemple 9 (acylation d'amines)(9):
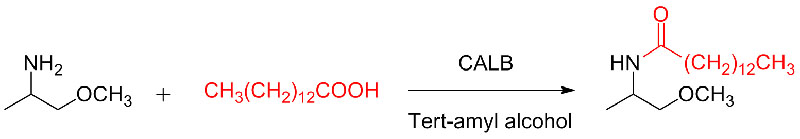

Exemple 10 (réaction d'addition Aza-Michael)(dix):
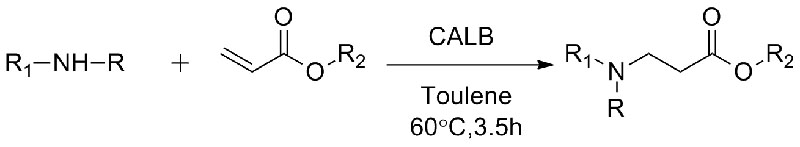
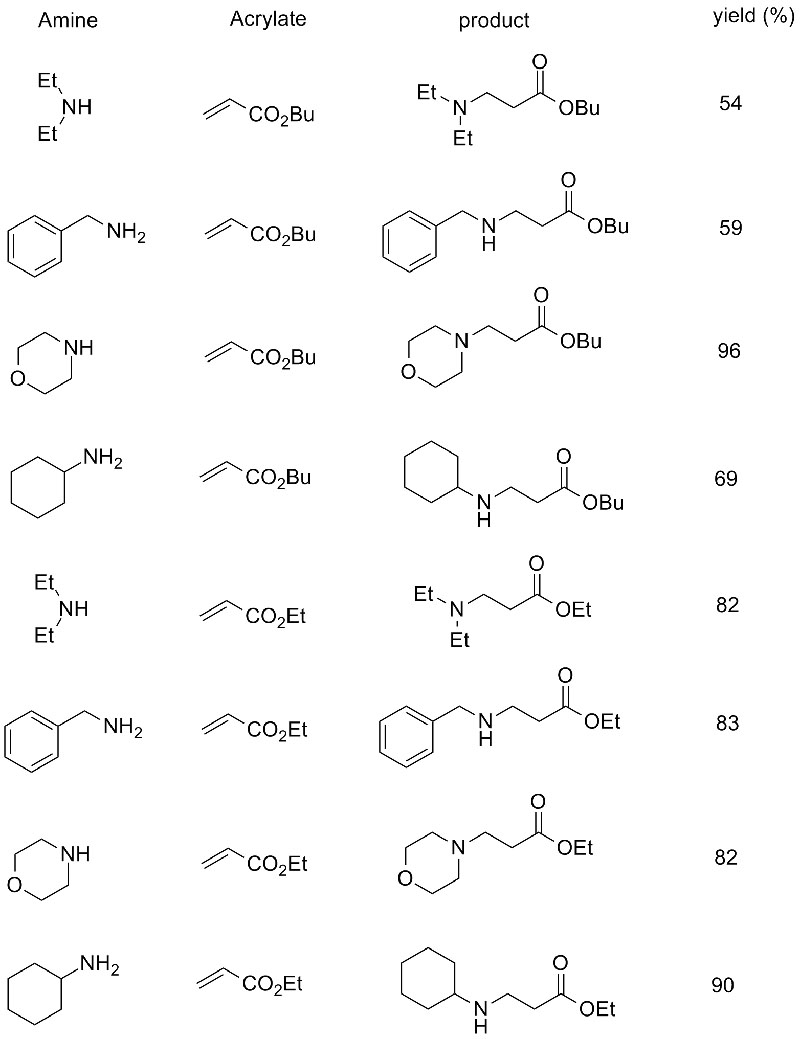
1. Chen S, Liu F, Zhang K, et al.Tetrahedron Lett, 2016, 57 : 5312-5314.
2. Olah M, Boros Z, anszky GH, et al.Tétraèdre, 2016, 72 : 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et al.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ing. Ing.Chem, 2015, 31 : 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B : Enzyme, 2016, 132 : 61-66.
6. Shinde SD, Yadav GD. Process Biochem, 2015, 50 : 230-236.
7. Souza TC, Fonseca TS, Costa JA, et al.J. Mol.Catal.B : Enzyme, 2016, 130 : 58-69.
8. Gavil´an AT, Castillo E, L´opez-Mungu´AJ Mol.Catal.B : Enzym, 2006, 41 : 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et al.J. Mol.Catal.B : Enzyme, 2013, 85-86 : 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et al.Tetrahedron Lett, 2010, 51 : 4455-4458.