Amidase (AMD)
Enzymes :Sont des catalyseurs biologiques macromoléculaires, la plupart des enzymes sont des protéines
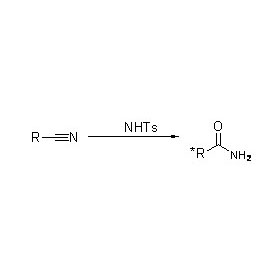
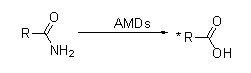
Amidase :Catalyser l'hydrolyse de divers amides aliphatiques et aromatiques endogènes et étrangers en transférant un groupe acyle à l'eau avec la production d'acides libres et d'ammoniac.Les acides hydroxamiques et autres acides organiques sont largement utilisés comme médicaments car ils sont des constituants de facteurs de croissance, d'antibiotiques et d'inhibiteurs de tumeurs.Les amidases peuvent être divisées en acylases de type R et de type S selon la stéréosélectivité du catalyseur.
En plus de catalyser l'hydrolyse des amides, l'amidase peut également catalyser les réactions de transfert d'acyle en présence de co-substrats tels que l'hydroxylamine.
Les amidases de différentes sources ont une spécificité de substrat différente, certaines d'entre elles ne peuvent hydrolyser que les amides aromatiques, certaines d'entre elles ne peuvent hydrolyser que les amides aliphatiques et certaines hydrolysent les α- ou ω-amino amides.La plupart des amines ont une bonne activité catalytique uniquement pour les amides aromatiques acycliques ou simples, mais pour les composés aromatiques complexes, les amides hétérocycliques, en particulier les amides avec des substituants ortho, ont généralement une faible activité (seules quelques enzymes présentent de meilleurs effets catalytiques).
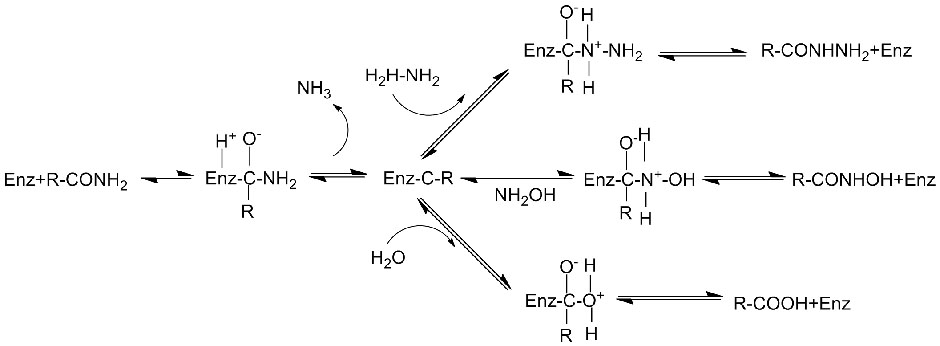
Mécanisme catalytique :
| Enzymes | Code produit | Code produit |
| Poudre d'enzymes | ES-AMD-101~ ES-AMD-119 | un ensemble de 19 amidases, 50 mg chacun 19 articles * 50mg/article, ou autre quantité |
| Trousse de dépistage (SynKit) | ES-AMD-1900 | un ensemble de 19 amidases, 1 mg chacun 19 éléments * 1 mg/élément |
★ Haute spécificité de substrat.
★ Forte sélectivité chirale.
★ Efficacité de conversion élevée.
★ Moins de sous-produits.
★ Conditions de réaction douces.
★ Respectueux de l'environnement.
➢ Le criblage enzymatique doit être effectué pour des substrats spécifiques en raison de la spécificité du substrat, et obtenir une enzyme qui catalyse le substrat cible avec le meilleur effet catalytique.
➢ Ne jamais entrer en contact avec des conditions extrêmes telles que : température élevée, pH élevé/bas et solvant organique à haute concentration.
➢ Normalement, le système de réaction doit inclure un substrat, une solution tampon (le pH de réaction optimal de l'enzyme).Des co-substrats tels que l'hydroxylamine doivent être présents dans le système de réaction de transfert d'acyle.
➢ AMD doit être ajouté en dernier dans le système de réaction avec un pH et une température de réaction optimaux.
➢ Tous les types de DMLA ont diverses conditions de réaction optimales, de sorte que chacun d'eux doit être étudié plus en détail individuellement.
Exemple 1(1):
Activité d'hydrolyse sur différents substrats amides
| Substrat | Activité spécifique μmol min-1mg-1 | Substrat | Activité spécifique μmol min-1mg-1 |
| Acétamide | 3.8 | ο-OH benzamide | 1.4 |
| Propionamide | 3.9 | p-OH benzamide | 1.2 |
| lactamide | 12.8 | ο-NH2benzamide | 1.0 |
| Butyramide | 11.9 | p-NH2benzamide | 0,8 |
| Isobutyramide | 26.2 | ο-Toluamide | 0,3 |
| Pentanamide | 22,0 | p-Toluamide | 8.1 |
| Hexanamide | 6.4 | Nicotinamide | 1.7 |
| Cyclohexanamide | 19.5 | Isonicotinamide | 1.8 |
| Acrylamide | 10.2 | Picolinamide | 2.1 |
| Métacrylamide | 3.5 | 3-Phénylpropionamide | 7.6 |
| Prolinamide | 3.4 | Indol-3-acétamide | 1.9 |
| Benzamide | 6.8 |
La réaction a été effectuée dans une solution tampon de phosphate de sodium 50 mM, pH 7,5, à 70 ℃.
| Amides | Hydroxylamine | Hydrazine |
| Acétamide | 8.4 | 1.4 |
| Propionamide | 18.4 | 3.0 |
| Isobutyramide | 25,0 | 22,7 |
| Benzamide | 9.2 | 6.1 |
La réaction a été effectuée dans une solution tampon de phosphate de sodium 50 mM, pH 7,5, à 70 ℃.
Concentration de réactif associée : amides, 100 mM (benzamide, 10 mM) ;hydroxylamine et hydrazine, 400 mM;enzyme 0,9 µM.
Exemple 2(2):
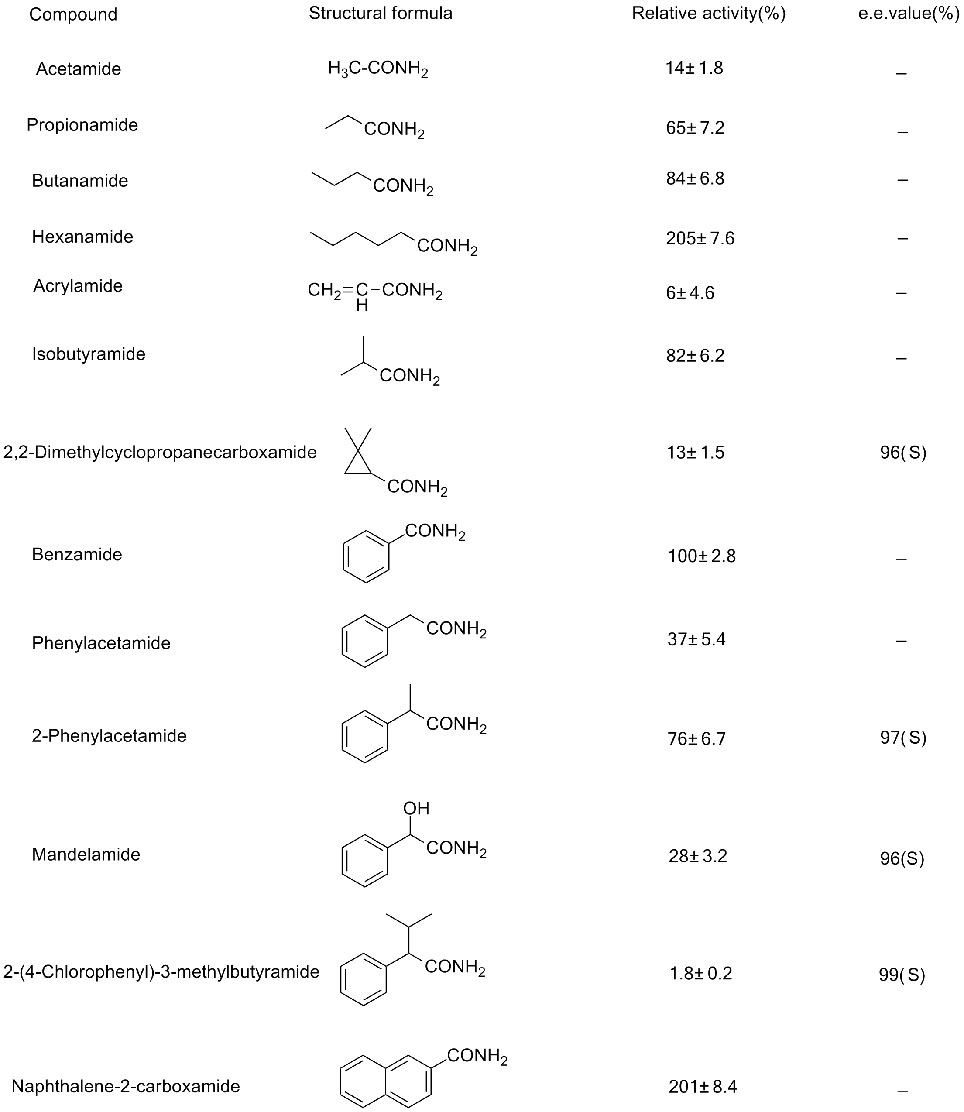
Exemple 3(3):
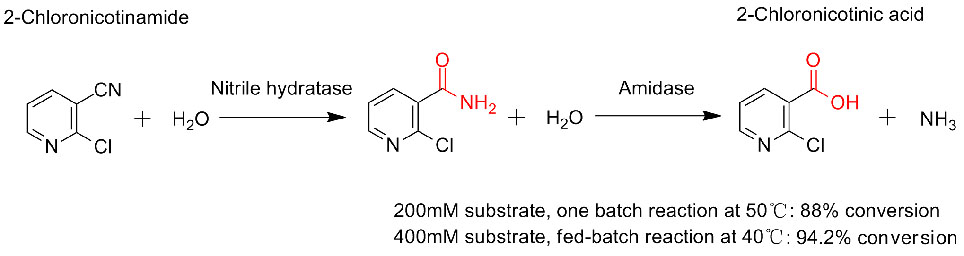
1. D'Abusco AS, Ammendola S., et al.Extrémophiles, 2001, 5:183-192.
2. Guo FM, Wu JP, Yang LR, et al.Process Biochemistry, 2015, 50(8): 1400-1404.
3. Zheng RC, Jin JQ, Wu ZM, et al.Chimie bioorganique, 2017, disponible en ligne 7.